在湖南省設(shè)立并運(yùn)營第一類醫(yī)療器械生產(chǎn)企業(yè),需嚴(yán)格遵循《醫(yī)療器械監(jiān)督管理?xiàng)l例》及湖南省藥品監(jiān)督管理局的相關(guān)規(guī)定。整個(gè)流程主要分為兩大核心環(huán)節(jié):生產(chǎn)企業(yè)備案與技術(shù)服務(wù)文件制作。以下為您詳細(xì)解析具體步驟與要求。
一、 第一類醫(yī)療器械生產(chǎn)企業(yè)生產(chǎn)備案流程
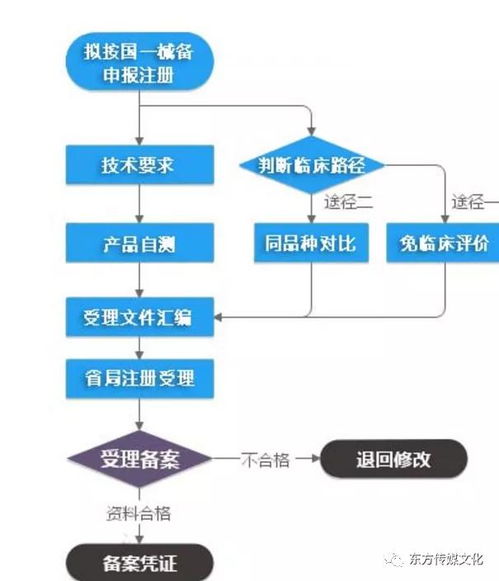
生產(chǎn)備案是企業(yè)合法生產(chǎn)的前提,屬于事前備案管理。流程如下:
- 前期準(zhǔn)備與自我評估
- 確認(rèn)產(chǎn)品類別:根據(jù)《第一類醫(yī)療器械產(chǎn)品目錄》,明確擬生產(chǎn)產(chǎn)品是否屬于第一類醫(yī)療器械。
- 具備生產(chǎn)條件:確保擁有與所生產(chǎn)產(chǎn)品相適應(yīng)的生產(chǎn)場地、環(huán)境、設(shè)備、倉儲(chǔ)條件、質(zhì)量管理人員及專業(yè)技術(shù)人員。
- 建立質(zhì)量管理體系:建立并保持符合《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》基本要求的質(zhì)量管理體系。
- 在線填報(bào)與材料提交
- 登錄平臺(tái):訪問“湖南省藥品監(jiān)督管理局行政許可與備案管理系統(tǒng)”或“湖南政務(wù)服務(wù)網(wǎng)”相應(yīng)入口。
- 填寫信息:在線如實(shí)、完整填寫《第一類醫(yī)療器械生產(chǎn)備案表》。核心信息包括:企業(yè)基本信息、備案人信息、生產(chǎn)產(chǎn)品列表、生產(chǎn)地址、質(zhì)量負(fù)責(zé)人信息等。
- 上傳材料:根據(jù)系統(tǒng)指引,掃描并上傳以下材料的PDF電子版(需加蓋企業(yè)公章):
- 營業(yè)執(zhí)照副本。
- 法定代表人、企業(yè)負(fù)責(zé)人、生產(chǎn)負(fù)責(zé)人、質(zhì)量負(fù)責(zé)人的身份證明、學(xué)歷或職稱證明。
- 生產(chǎn)場地證明文件(如產(chǎn)權(quán)證明、租賃協(xié)議)。
- 所生產(chǎn)產(chǎn)品的醫(yī)療器械備案憑證復(fù)印件(若產(chǎn)品已完成備案)。
- 產(chǎn)品技術(shù)要求、產(chǎn)品說明書及標(biāo)簽樣稿。
- 質(zhì)量管理體系文件目錄。
- 辦理人授權(quán)書及身份證明。
- 提交與形式審查
- 確認(rèn)信息無誤后在線提交申請。
- 市級(jí)市場監(jiān)督管理部門(藥品監(jiān)管部門)對提交材料的完整性、規(guī)范性進(jìn)行形式審查。材料不齊全或不符合要求的,會(huì)一次性告知需要補(bǔ)正的內(nèi)容。
- 備案憑證發(fā)放
- 形式審查通過后,監(jiān)管部門將在系統(tǒng)內(nèi)完成備案,并生成《第一類醫(yī)療器械生產(chǎn)備案憑證》(電子或紙質(zhì)形式)。企業(yè)可自行在系統(tǒng)中查詢、下載、打印備案憑證。
- 重要提示:備案完成后,企業(yè)信息及產(chǎn)品信息將依法向社會(huì)公開。備案不代表監(jiān)管部門對產(chǎn)品安全性的認(rèn)可,企業(yè)需對產(chǎn)品全生命周期質(zhì)量負(fù)主體責(zé)任。
二、 技術(shù)服務(wù)文件制作要點(diǎn)
技術(shù)服務(wù)文件是產(chǎn)品設(shè)計(jì)開發(fā)、生產(chǎn)、質(zhì)量控制的核心依據(jù),也是備案和現(xiàn)場核查的重點(diǎn)。主要包含以下內(nèi)容:
- 產(chǎn)品技術(shù)要求
- 這是最核心的技術(shù)文件,應(yīng)按照《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》制定。
- 內(nèi)容應(yīng)包括:產(chǎn)品型號(hào)/規(guī)格及其劃分說明、性能指標(biāo)(物理、化學(xué)、生物等)、檢驗(yàn)方法、術(shù)語定義等。指標(biāo)應(yīng)明確、可量化、可檢驗(yàn)。
- 必須與產(chǎn)品特性、預(yù)期用途相符,并引用適用的國家/行業(yè)標(biāo)準(zhǔn)。
- 風(fēng)險(xiǎn)管理文件
- 依據(jù)YY/T 0316《醫(yī)療器械風(fēng)險(xiǎn)管理對醫(yī)療器械的應(yīng)用》標(biāo)準(zhǔn),對產(chǎn)品全生命周期進(jìn)行風(fēng)險(xiǎn)管理。
- 內(nèi)容應(yīng)包括:風(fēng)險(xiǎn)分析、風(fēng)險(xiǎn)評價(jià)、風(fēng)險(xiǎn)控制措施及剩余風(fēng)險(xiǎn)可接受性評價(jià)報(bào)告。需證明產(chǎn)品風(fēng)險(xiǎn)已得到有效控制,且受益大于風(fēng)險(xiǎn)。
- 產(chǎn)品說明書和標(biāo)簽
- 內(nèi)容與格式需符合《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》。
- 說明書:應(yīng)包含產(chǎn)品名稱、型號(hào)規(guī)格、備案人/生產(chǎn)企業(yè)信息、產(chǎn)品性能、主要結(jié)構(gòu)組成、預(yù)期用途、使用方法、注意事項(xiàng)、禁忌癥、儲(chǔ)存條件、有效期等。語言應(yīng)科學(xué)、準(zhǔn)確、易懂。
- 標(biāo)簽:至少標(biāo)注產(chǎn)品名稱、備案人/生產(chǎn)企業(yè)名稱與地址、產(chǎn)品備案號(hào)、生產(chǎn)日期/批號(hào)、有效期等。
- 研究資料與驗(yàn)證報(bào)告
- 產(chǎn)品性能研究:提供證明產(chǎn)品滿足技術(shù)要求的實(shí)驗(yàn)數(shù)據(jù)、研究報(bào)告(如物理性能、化學(xué)性能、生物安全性評價(jià)等)。
- 工藝驗(yàn)證報(bào)告:關(guān)鍵工序和無菌產(chǎn)品生產(chǎn)過程的驗(yàn)證報(bào)告。
- 包裝驗(yàn)證報(bào)告:證明產(chǎn)品在規(guī)定的儲(chǔ)存和運(yùn)輸條件下能保持穩(wěn)定性的驗(yàn)證資料。
- 滅菌驗(yàn)證報(bào)告(如適用):提供滅菌方法、過程參數(shù)及有效性驗(yàn)證報(bào)告。
- 質(zhì)量管理體系文件
- 提供與生產(chǎn)活動(dòng)相關(guān)的質(zhì)量管理體系文件目錄,如質(zhì)量手冊、程序文件、作業(yè)指導(dǎo)書、記錄表格等,以證明具備穩(wěn)定生產(chǎn)合格產(chǎn)品的能力。
與建議
湖南省第一類醫(yī)療器械生產(chǎn)企業(yè)的設(shè)立,關(guān)鍵在于“備案合規(guī)”與“技術(shù)扎實(shí)”。企業(yè)務(wù)必確保備案信息真實(shí)準(zhǔn)確,并投入足夠資源構(gòu)建科學(xué)、完整、可追溯的技術(shù)文件體系。建議企業(yè):
- 在籌備初期,詳細(xì)研究法規(guī)和指導(dǎo)原則,或咨詢專業(yè)法規(guī)服務(wù)機(jī)構(gòu)。
- 建立專職的法規(guī)事務(wù)與質(zhì)量管理團(tuán)隊(duì)。
- 技術(shù)文件制作應(yīng)貫穿于產(chǎn)品設(shè)計(jì)開發(fā)全過程,而非事后補(bǔ)做。
- 關(guān)注湖南省藥監(jiān)局官網(wǎng)的動(dòng)態(tài),及時(shí)跟進(jìn)法規(guī)與流程的更新。
通過嚴(yán)謹(jǐn)、規(guī)范的流程操作,企業(yè)不僅能順利取得生產(chǎn)資質(zhì),更能為產(chǎn)品的長期質(zhì)量安全與市場競爭力奠定堅(jiān)實(shí)基礎(chǔ)。